在印度生产的美国厂牌眼药水在国内造成三死八失明悲剧,食品暨药物管理局(FDA)发布初步调查报告指出,在印度的制造厂无法保证无菌的生产环境。
图源:AP
美国政府2月底到3月初派员前往印度南部塔米尔纳度省(Tamil Nadu)全球制药保健公司(Global Pharma Healthcare)厂房稽查,发现眼药水制造和检验过程有十几个问题,最大的问题是无法保证产品无菌,尤其是在2020年12月到2022年4月间制造后运回美国销售的产品批量。
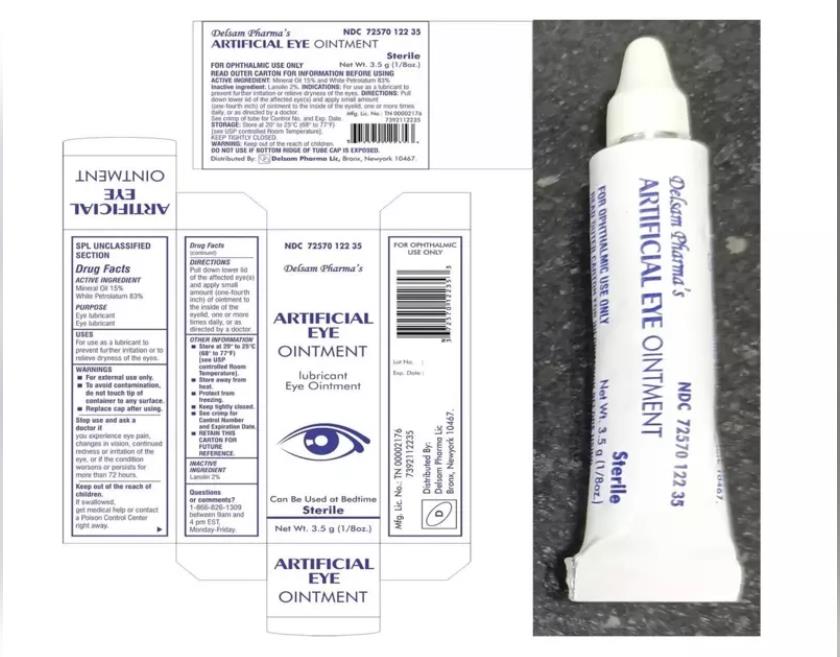
这批眼药水是由EzriCare和Delsam Pharma两大厂牌委托生产,因受到绿脓杆菌(Pseudomonas aeruginosa)污染,在美国已造成68件感染病例,导致三人死亡,八人失明,四人摘除眼球以保命,目前这些批量已全数回收。
这波感染事件特别让人担心的原因是绿脓杆菌抗药性极强,一般抗生素对付不了。
2月3日美国宣布回收问题产品,卫检人员2月20日抵达印度工厂稽查。这是食药局人员首次到该厂检验。
食药局发言人坎恩(Jeremy Khan)说,初步报告显示,药厂“可能违反了食药局的规定”,待正式报告出炉,会发警告函给厂商。他呼吁消费者停止使用该厂生产的眼药水,因为“可能有害健康”。
食药局官员在全球制药公司的印度厂现场视察时,发现工厂的地板、墙壁、天花板都“不易清理”,装填机器的设备还包着或用东西盖住,缺乏严格的品管作业,有些药瓶居然无法完全密闭,仅靠人眼检查是否有泄漏。
食药局偕同疾病防治中心(CDC)调查,发现受感染病患用过的EzriCare眼药水里有病菌株。食药局官员也在检查未开封过的眼药水是否带菌。